현재까지는 태양계 행성 중에서 물이 존재하는 곳은 지구뿐이다. 지구 표면의 약 70%는 물로 덮여 있으며, 또한 이 물이라는 것은 지구상에 존재하는 모든 생물이 생활하는 데 매우 중요한 존재이기도 하다. 물에는 어떠한 성질들이 있는지 살펴본다.
1. 물의 분포와 중요성
지구상에 존재하는 물 중에서 약 99%가 바다와 염수, 극지방의 빙하에 분포되어 있으며 나머지는 지하수, 염호, 호수, 강 및 공기 중의 수증기로 존재하고 있다.
이 중 우리가 먹을 수 있는 물은 극히 일부분에 불과하다.
지구에 있는 물의 일부는 태양 에너지에 의해 증발되어 수증기가 되면서 대기 중으로 날아가고, 그 수증기는 기온이 낮은 곳에서 응축되어 구름이나 안개가 되며, 눈이나 비, 우박 등으로 지상에 내린 다음 하천을 거쳐서 바다로 흘러간다.
물은 지구상의 모든 생물의 생명 유지에 필수적인 존재이다. 사람만 하더라도 인체의 약 66%가 물로 구성되어 있으며, 여기에서 1~2%만 빠져나가도 갈증을 느끼게 되고 약 5%을 잃게 되면 혼수 상태에 빠지게 되며 12% 이상을 잃으면 생명을 잃게 된다. 사람은 매일 적당한 양의 물을 섭취해야 생명과 건강을 유지할 수 있다.
2. 물의 구성 성분과 물 분자의 구조
1800년대에 이미 원자설을 주장한 영국의 돌턴과 기체 반응의 법칙을 제시한 게이 뤼삭은 물을 구성하고 있는 성분과 물을 전기 분해할 때 생성되는 기체의 질량비와 부피비를 밝혀 내었다.
물에는 물 분자 이외에 극히 적은 수이지만 수소 이온과 수산화 이온이 함께 존재한다.

물 속에 전기를 통해 주면, 양전하를 띤 수소 이온은 반대 전하의 (-)극쪽으로 끌려 가며, 전자를 받아 수소 기체를 생성한다.

한편, 음전하를 띤 수산화 이온은 (+)극 쪽으로 끌려가서 전자를 내어놓고 물과 산소를 생성한다.
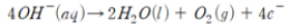
과학자들의 실험에 의하면 물 분자는 수소 두 원자와 산소 한 원자가 전자쌍을 서로 공유함으로써 결합한 물질이며, 물 분자 자체는 중성이지만 수소 원자 쪽에 약한 양전하를, 산소 원자 쪽에 약한 음전하를 띠고 있어서 물 분자를 굽은 구조로 나타내고 있다.
이와 같은 물 분자의 전기적 성질 때문에 물 분자의 수소 원자와 다른 물 분자의 산소 원자 사이에는 약한 힘이 작용한다. 이것을 수소 결합이라고 한다.
3. 물의 끓는점과 비열
물은 열에너지가 공급되면 다른 액체에 비하여 높은 온도까지 올라가므로 여러 가지 음식을 익혀 먹을 수 있다.
순수한 물은 1기압, 100℃에서 끓는다. 아세톤은 이보다 낮은 56.5℃에서 끓는다. 이처럼 물의 끓는점이 아세톤의 끓는점보다 높은 것은 물 분자의 구조와 관련이 있다.
물의 끓는점이 아세톤보다 높은 것은 물 분자 사이의 수소 결합으로 인한 인력이 아세톤 분자 사이에 작용하는 인력보다 크기 때문이다. 즉, 물 분자 사이의 수소 결합을 끊어 기체 상태로 변화시키는 것이 아세톤 분자 사이의 인력을 끊어 기체 상태로 변화시키는 것보다 더 많은 에너지가 필요하기 때문이다.
물은 다른 액체에 비하여 녹는점, 끓는점, 비열, 기화열 등이 높다. 이는 모두 물 분자 사이에 작용하는 수소 결합 때문에 나타나는 현상이다. 녹는점, 기화열 등은 위에서 설명한 끓는점과 같은 이유로 다른 물질보다 높게 나타난다.
비열이 큰 물질의 경우 같은 양의 열에너지를 가할 때 비열이 작은 물질보다 온도가 조금 올라간다. 물의 비열이 큰 것은 물 분자 사이의 수소 결합에 에너지를 저장할 수 있기 때문이다. 따라서 다른 액체보다 물은 쉽게 뜨거워지거나 빨리 식지 않는다.
우리 몸이 더운 여름철이나 추운 겨울철에 체온을 일정하게 유지시킬 수 있는 것이나 해안 지방이 대륙 지방보다 낮과 밤의 기온 차가 적은 것은 물의 이러한 성질과 관련이 깊다.
4. 물의 표면 장력
해가 뜨기 직전의 이른 아침에 산에 가보면 풀잎에 맺힌 둥근 이슬 방울을 볼 수 있다. 또한 집의 수도 꼭지에서 떨어지는 물방을 보아도 모양이 둥글다. 이런 현상은 바로 물의 표면 장력과 관련이 있다.
물의 안쪽에 있는 분자는 모든 방향의 분자로부터 같은 크기의 힘으로 끌린다. 그러나 물의 표면에 있는 분자는 안쪽에 있는 분자들에 의해서만 끌린다. 이러한 안쪽으로 끌리는 힘 때문에 표면에 있는 물 분자 수가 줄어들어 표면적이 작아진다.
이와 같이 액체가 그 표면을 작게 하려는 성질을 표면 장력이라고 한다. 물방울이 공 모양을 하고 있는 것은 일정량의 물이 가장 작은 표면적으로 갖는 것이 공 모양이기 때문이다.
5. 물의 상태에 따른 부피 변화
겨울에 날씨가 몹시 추워지면 수도 사업소에서는 수도관이 터졌다는 신고를 많이 받는다. 또 시골 장독대에 물이 들어 있던 항아리가 깨어지는 일이 종종 일어난다. 이는 물의 온도를 낮추면 물의 부피가 커지기 때문에 발생하는 현상이다.
즉, 물은 다른 물질과는 달리 얼어서 고체로 될 때 부피가 늘어난다. 물이 얼면 부피가 커지는 것은 물의 물리적 성질과 관련이 있다.
물에 얼음을 넣으면 얼음이 물 위에 뜬다. 이것은 얼음이 물보다 밀도가 작은 것을 의미한다. 가령 물은 4℃일 때 밀도가 가장 크므로 부피가 최소가 되는 것이다. 또한 온도가 0℃보다 낮아지면 수소 결합에 의해 분자들이 규칙적인 배열을 하여 빈 공간이 늘어나며 같은 질량의 얼음의 밀도는 물보다 작아지므로 부피는 커진다.
6. 물의 용해성
우리는 소금이나 설탕이 기름에 잘 녹지 않지만 물에는 잘 녹는다는 사실을 알고 있다.
소금은 양전하를 띤 나트륨 이온과 음전하를 띤 염화 이온이 결합된 물질이다.
소금이 물에 들어가면 물 분자가 소금의 표면에 충돌하면서 물 분자의 음전하를 띤 산소 쪽에서 양이온인 나트륨 이온을 끌어당기고, 양전하를 띤 수소 쪽에서 음이온인 염화 이온을 끌어 당긴다. 그 결과 결정을 이루고 있는 나트륨이온과 염화 이온 사이의 인력이 약해지고 이어서 결정이 부서진다. 나트륨 이온과 염화 이온은 물 분자에 둘러싸여 물 속으로 떨어져 나가 각각 몇 개의 물 분자를 끌어당긴 상태로 녹아 있게 된다.
'상식 및 정보' 카테고리의 다른 글
| 화학 개요 (0) | 2022.01.05 |
|---|---|
| 미적분 발견의 역사 (0) | 2022.01.04 |
| 펠로폰네소스 전쟁 - 그리스 지배권 쟁탈전 (0) | 2022.01.01 |
| 빵 - 세계의 빵 (0) | 2021.12.31 |
| 보석 문화 및 보석 문화의 교류 (0) | 2021.12.30 |
댓글